CENTRO DE BACHILLERATO TECNOLÓGICO
industrial y de servicios No.199
DESARROLLO DE TÉCNICAS PARASITOLOGICAS
3º Semestre
Laboratorio Clínico
"Método
de concentración-Flotación de Faust"
FECHA: 12/09/2018 GRUPO: 3º DV EQUIPO:1
- INTRODUCCIÓN
En este método se utiliza
solución de Zn, cuya densidad especifica es de 1.180(33%), que conforma un
medio de densidad más alta que la de los huevos: Necátor 1.055, Tricocéfalo 1.150,
Áscaris fértil 1.110 y facilita que
los huevos livianos de estos helmintos, con mejor peso específico que la
solución, se concentren y floten.
La concentración
adecuada aconsejada es la que usa como reactivo una solución acuosa de sulfato
Zn al 33% con una densidad al 1.180. El agua utilizada diluye y lava la materia
fecal. El filtrado con gasa doblada y evita que los detritos gruesos traspasen
las paredes, la centrifugación enriquece en delgada película la superficie del
líquido centrifugado con los huevos livianos de algunos helmintos.
- OBJETIVO
- FUNDAMENTO
Faust implementó la técnica de copropoparasitoscópico en 1938. Es una técnica fácil, muy utilizada en los laboratorios clínicos, y es más especifica para quistes y trofozoitos. Es importante que la solución de sulfato de zinc tenga la concentración adecuada, es decir, 1.18° Baumé, ya que es la que provoca la diferencia de densidad y que las formas buscadas floten.
- MATERIAL
- - Muestra de heces fecales - Mechero
- - Abate lenguas - Agua
destilada
- - Aplicador de madera - vaso de
precipitado
- Embudo - Tubo
de centrifuga
TÉCNICA
1) Mezclar bien una porción de materia
fecal para preparar una superficie en 10 partes de agua destilada.
2) Filtrar la suspensión atraves de una
gasa doblada en cuatro, sobre un tubo de centrifuga, ayudándose de un embudo
pequeño.
3)
Centrifugar el filtrado a 2500 rpm por 1
min.
4) Decantar el líquido sobrenadante y
completar con agua hasta igualar la medida anterior, centrifugar nuevamente.
Resuspender el sedimento.
5) Repetir el procedimiento 2 veces hasta
que el líquido sobrenadante esté listo.
6) Decantar nuevamente el líquido
sobrenadante reemplazándolo por igual cantidad de solución de sulfato de Zn al 33%.
Mezclar bien la solución con el sedimento. Centrifugar bien por 1 min a 1500
rpm.
7)
Tomar 3-4 gotas de las partículas que
flotan en la superficie del líquido. Colocarlos en un porta-objeto y mezclarla
con 1-2 gotas de lugol, colocar el cubre-objeto.
8)
Examinar al microscopio y reporte sus
resultados.
DESARROLLO
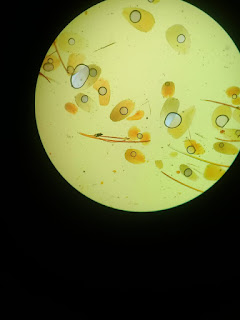
- RESULTADOS
Al observar en el
microscopio se encontraron Quistes o huevos de áscares
- CONCLUSIÓN
Esta
técnica permite la separación de quistes de protozoos y huevos de ciertos
helmintos del exceso de residuos mediante el uso de soluciones con elevada
gravedad específica. Los elementos parasitarios son recuperados de la capa
superficial y los residuos se mantienen en el fondo del tubo. Con esta técnica
los preparados son más limpios que los obtenidos por sedimentación.