CENTRO DE BACHILLERATO TECNOLÓGICO
industrial y de servicios No.199
DESARROLLO DE TÉCNICAS PARASITOLOGICAS
3º Semestre
Laboratorio Clínico
''Método cuantitativo de frotis grueso Kato''
FECHA: 20/10/2018 GRUPO: 3º DV EQUIPO:1
INTRODUCCIÓN
Este método fue descrito por Kato y Miura en 1954 a este se
le denomina como frote grueso.
Esta fue evaluada por Komiya y Kobashi y Martin Beaver,
quienes introdujeron la modificación de pasar la materia fecal por una malla
para evitar el paso de fibras y restos alimenticios no digeridos, lo que mejoro
la técnica original.
Podría decirse que esta es la técnica muy sencilla en cuanto
en materias y reactivos a utilizar, en cuanto a los cálculos para el reporte de
resultados estos no representan mayor problema.
El principal motivo por el cual se utiliza este método es
para diagnosticar y cuantificar el hallazgo de huevos, lo cual podría decirse
que los resultados que nos dan son la concentración de huevos por gramo de
heces.
FUNDAMENTO
- Método cuantitativo de helmintos, el cual se basa en la acción que tiene la glicerina alrededor de los huevos y el verde de maloquita como colorante de contraste.
OBJETIVO
- El alumno debe de realizar y comprender un método cuantitativo de helmintos, mediante el desarrollo de una practica de laboratorio.
MATERIALES
- Aplicadores de madera.
- Papel celofán.
- Glicerina
- verde de malaquita al 3%.
- Microscopio
MÉTODO
- Con un abate lenguas pesar 50 mg de materia fecal a una porta objetos.
- Cubrir la muestra con el cubreobjetos de celofán embebido en la solución de verde de malaquita y glicerina. Invertir la preparación, presionar sobre una hoja de papel filtrar contra la superficie de la mesa de trabajo para lograr la extensión de la muestra hasta cubrir un área de 20 a 25 mm de diámetro.
- Dejar reposar la preparación con un cubre objetos de papel celofán hacia arriba durante una hora a temperatura ambiente o a 30 min. a 34-40°C esto motivara la aclaración de las heces sin se que aclaren los huevos de helmintos.
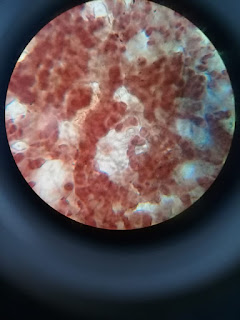
- Observar al microscopio, hacer el conteo de los huevos de que se encuentran en la preparación. Para obtener la cifra total, cada cuenta alcanza, multiplicar por el factor correspondiente para expresarlo en huevos por gramos de heces.
- Debe evitarse exceder el tiempo de aclaraciones porque esto dificultara la observación de los huevos de helmintos. Si fuese necesario demorar la observación.
PROCEDIMIENTO
RESULTADOS
- De acuerdo a la técnica que se realizó, los resultados que obtuvimos fueron negativos ya que no se encontró ningún huevo o indicio de algún microorganismo en el capo de observación.
CONCLUSIÓN
- Esta técnica al ser uno de muchos métodos cuantitativos de helmintos, conlleva en si una gran importancia pues con esta se puede confirmar la cantidad aproximada de microorganismos infectantes dentro de un hospedero. Convirtiéndose en una técnica conveniente para completar el diagnostico de un análisis.
REFERENCIAS